
Rudolf Cole
0
4870
1068
Als u ooit een recept heeft ingenomen, een auto heeft gereden of kraanwater heeft gedronken, bent u waarschijnlijk blootgesteld aan chloor.
Chloor, element nr. 17 op het periodiek systeem der elementen, kent meerdere toepassingen. Het wordt gebruikt om drinkwater te steriliseren en om zwembaden te desinfecteren, en het wordt gebruikt bij de productie van een aantal veelgebruikte producten, zoals papier, textiel, medicijnen, verf en plastic, met name PVC, volgens de Royal Society of Chemistry. . Bovendien wordt volgens de American Chemistry Council chloor gebruikt bij de ontwikkeling en fabricage van materialen die worden gebruikt in producten die voertuigen lichter maken, van zitkussens en stoelhoezen tot bandkoorden en bumpers..
Het element wordt ook gebruikt in organische chemische processen - bijvoorbeeld als oxidatiemiddel en als vervanging voor waterstof, volgens het Los Alamos National Laboratory. Een oxidatiemiddel heeft sterke desinfecterende en blekende eigenschappen. Bij gebruik als waterstofvervanger kan chloor veel gewenste eigenschappen in organische verbindingen brengen, zoals de desinfecterende eigenschappen of het vermogen om nuttige verbindingen en materialen te vormen zoals PVC en synthetisch rubber.
Maar chloor heeft ook een donkere kant: in zijn aardgasvorm is het schadelijk voor de menselijke gezondheid. Chloor is irriterend voor de luchtwegen en inademing kan longoedeem veroorzaken - een overmatige ophoping van vocht in de longen die tot ademhalingsmoeilijkheden kan leiden. Het gas kan ook oog- en huidirritatie veroorzaken, of zelfs ernstige brandwonden en ulceraties, volgens het New York State Department of Health. Blootstelling aan gecomprimeerd vloeibaar chloor kan bevriezing van de huid en ogen tot gevolg hebben, meldt het bureau.
Gewoon de feiten
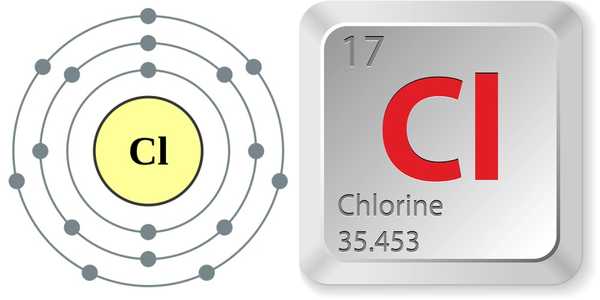
- Atoomnummer (aantal protonen in de kern): 17
- Atoomsymbool (op het periodiek systeem der elementen): Cl
- Atoomgewicht (gemiddelde massa van het atoom): 35.453
- Dichtheid: 3,214 gram per kubieke centimeter
- Fase bij kamertemperatuur: gas
- Smeltpunt: minus 150,7 graden Fahrenheit (minus 101,5 graden C)
- Kookpunt: minus 29,27 F (minus 34,04 C)
- Aantal isotopen (atomen van hetzelfde element met een verschillend aantal neutronen): 24. Aantal stabiele isotopen: 2
- Meest voorkomende isotopen: chloor-35 (76 procent natuurlijke abundantie)
Groenachtig geel gas dat wordt aangezien voor zuurstof
In 1774 gaf de Zweedse apotheker Carl Wilhelm Scheele in zijn laboratorium een paar druppels zoutzuur af op een stukje mangaandioxide, en volgens de American Chemistry Council werd binnen enkele seconden een groenachtig geel gas geproduceerd. Chloor werd echter pas enkele decennia later herkend als een element door de Engelse chemicus Sir Humphry Davy, en daarvoor dachten mensen dat het een verbinding van zuurstof was. Davy noemde het 'khloros', van het Griekse woord voor groenachtig geel, en in 1810 veranderde hij de naam in 'chloorgas' of 'chloor'.
Chloor behoort tot de groep van halogenen - zoutvormende elementen - samen met fluor (F), broom (Br), jodium (I) en astatine (At). Ze bevinden zich allemaal in de tweede kolom van rechts op het periodiek systeem in groep 17. Hun elektronenconfiguraties zijn vergelijkbaar, met zeven elektronen in hun buitenste schil. Het zijn zeer reactieve elementen; wanneer ze worden gebonden met waterstof, produceren ze zuren. Volgens Purdue University is er geen enkele in de natuur in hun elementaire vorm. Ze worden meestal aangetroffen als zouten in mineralen.
In feite is waarschijnlijk de meest bekende vorm van een chloorverbinding natriumchloride, ook wel bekend als keukenzout. Andere verbindingen zijn onder meer kaliumchloride, dat wordt gebruikt om lage kaliumspiegels in het bloed te voorkomen of te behandelen, en magnesiumchloride, dat wordt gebruikt om magnesiumtekort te voorkomen of te behandelen..
Volgens de Universiteit van York wordt het meeste chloor gemaakt via elektrolyse van natriumchlorideoplossingen - waarbij een elektrische stroom wordt gebruikt om een chemische reactie op te wekken. Het proces scheidt de elementen.
Wie weet?
- Vanwege zijn giftige eigenschappen werd chloor tijdens de Eerste Wereldoorlog gebruikt als chemisch wapen, volgens de Royal Society of Chemistry.
- Wanneer het wordt geïsoleerd als een vrij element, neemt chloor de vorm aan van een groenachtig geel gas, dat 2,5 keer zwaarder is dan lucht en naar bleek ruikt.
- Chloor is het op een na meest voorkomende halogeen en het op een na lichtste halogeen op aarde, na fluor.
- Natriumchloride (zout) is de meest voorkomende verbinding van chloor en komt in grote hoeveelheden voor in de oceaan.
- Er kan wat chloor in de kip zitten die je eet. Karkassen van kippen die afkomstig zijn van Amerikaanse fabrieksboerderijen worden vaak gedrenkt in chloor om zich te ontdoen van fecale besmetting.
- Chloor vernietigt ozon en draagt bij aan het proces van ozonafbraak. Volgens het Amerikaanse Environmental Protection Agency kan één chlooratoom zelfs wel 100.000 ozonmoleculen vernietigen voordat het uit de stratosfeer wordt verwijderd..
- Zwembaden zijn afhankelijk van chloor om ze schoon te houden. Volgens de American Chemistry Council moet het water in de meeste zwembaden twee tot vier delen per miljoen chloor bevatten. En dat sterke chloor dat je ruikt als je in het openbare zwembad zwemt, kan in feite een aanwijzing zijn dat er extra chloor nodig is om de chemicaliën in het water in evenwicht te houden..
Onderzoek
Chloor heeft door de jaren heen nogal wat opschudding veroorzaakt onder onderzoekers vanwege bepaalde schadelijke effecten die het kan hebben op de menselijke gezondheid. Die effecten blijven echter discutabel.
Chloor is een van de atomen in een toxine dat sommige Zuid-Amerikaanse kikkers in hun huid hebben. Volgens de American Chemistry Council kan het grote dieren verlammen of zelfs doden. Inwoners van het Colombiaanse tropische regenwoud wreven de toppen van hun pijlen over de huid van deze "pijlgifkikkers". John Daly, een wetenschapper bij de National Institutes of Health, probeerde de verbinding, epibatidine genaamd, te isoleren, maar kreeg geen genoeg van de stof (de kikkers worden bedreigd), en wat hij synthetiseerde, had ongewenste bijwerkingen. Door de verbinding echter op atomair niveau te herschikken, hopen chemici dat ze uiteindelijk een versie kunnen vinden die een krachtige pijnstiller is..
Eerder onderzoek heeft het drinken van chloorwater in verband gebracht met een verhoogd risico op kanker. In een studie die in 1992 in het American Journal of Public Health werd gepubliceerd, ontdekten onderzoekers bijvoorbeeld dat mensen die chloorwater dronken een 21 procent hoger risico hadden om blaaskanker te krijgen, en een 38 procent hoger risico om rectumkanker te krijgen dan mensen die dronk niet-gechloreerd water. En in een andere studie, gepubliceerd in 2010 in het tijdschrift Environmental Health Perspectives, ontdekten onderzoekers dat mensen die 40 minuten in een chloorbad zwommen, verhoogde biomarkers (d.w.z. bepaalde moleculaire indicatoren) hadden die verband houden met het risico op kanker. Uit een in hetzelfde tijdschrift gepubliceerde studie uit 2017 bleek echter dat hoewel er een hoger risico op blaaskanker is bij het drinken van gechloreerd water, er weinig tot geen bewijs was dat zwemmen in een gechloreerd zwembad en het risico op blaaskanker in verband werden gebracht met het aantal uur in het zwembad tijdens de zomer- en niet-zomermaanden en tijdens verschillende leeftijdscategorieën.
Volgens de Centers for Disease Control and Prevention hebben het Amerikaanse ministerie van Volksgezondheid en Human Services, het International Agency for Research on Cancer en het U.S. Environmental Protection Agency chloor niet geclassificeerd als kankerverwekkend voor de mens..
Is chloor dus slecht voor uw gezondheid? Niet precies, zei Preston J. MacDougall, hoogleraar scheikunde aan de Middle Tennessee State University in Murfreesboro..
"Je wilt geen overmatige hoeveelheden chloor gebruiken, maar we moeten niet bang zijn voor chemische stoffen omdat we ze niet begrijpen", vertelde MacDougall. .
In feite is het gebrek aan geschikte chlorering om schadelijke bacteriën te doden, zoals E coli, kan verwoestende gevolgen hebben voor de menselijke gezondheid en het leven, voegde hij eraan toe. In mei 2000 stierven bijvoorbeeld in Walkerton, Ontario, zeven mensen en werden meer dan 2300 mensen ziek nadat de watervoorziening van de stad besmet raakte met E coli en andere bacteriën, stelt de Raad Waterkwaliteit en Gezondheid. Als de vereiste chloorniveaus waren gehandhaafd, had de ramp voorkomen kunnen worden, zelfs nadat het water was verontreinigd, volgens een rapport gepubliceerd door het ministerie van de procureur-generaal van Ontario..
Bovendien is het toevoegen van chloor aan water een methode die velen proberen om schoon water gemakkelijk toegankelijk te maken in ontwikkelingslanden. Een studie die in 2017 werd gepubliceerd, stelt dat 3,4 miljoen mensen elk jaar sterven aan water dat is verontreinigd met schadelijke bacteriën, zoals E coli, en dat tot 4,4 miljard mensen geen betrouwbare bron van schoon drinkwater hebben. Het chloorhouden van de watervoorziening en het dichter bij de gemeenschappen brengen van water is een belangrijke stap om schoon water dichter bij degenen die het nodig hebben, te brengen.
Daarnaast is er veelbelovend onderzoeksgerelateerd nieuws over chloor. MacDougall wees op een recent onderzoek naar chlooratomen die zijn aangetroffen in een nieuwe klasse van antibiotische verbindingen die zijn ontdekt in kleine mariene organismen in de Noord-Atlantische wateren nabij Noorwegen. Die chlooratomen zijn essentieel voor de antibiotische activiteit van de verbindingen, die effectief kunnen zijn tegen methicilline-resistent Staphylococcus aureus, een bacterie die moeilijk te behandelen infecties bij mensen veroorzaakt en resistent is tegen veelgebruikte antibiotica, zei hij.
"De gemeenschap van het ontdekken van geneesmiddelen is erg enthousiast over deze van nature voorkomende verbindingen omdat ze effectief zijn tegen MRSA", zei MacDougall, die niet betrokken was bij het onderzoek, gepubliceerd in april 2014 in het tijdschrift Angewandte Chemie International Edition.
Aanvullende rapportage door Rachel Ross, inzender.
Aanvullende bronnen
- Bekijk deze leuke video gemaakt door Periodic Videos om te zien hoe reactief chloor is wanneer het in wisselwerking staat met andere verbindingen.
- Lees meer over de talloze verrassende toepassingen van chloor op deze website genaamd Elements of Surprise die is gewijd aan dit veelzijdige element.
- Als u meer wilt weten over hoe blootstelling aan chloor uw gezondheid kan beïnvloeden, bekijk dan de sectie met veelgestelde vragen over chloor op de CDC-website.















