
Paul Sparks
0
2343
415
Wetenschappers kunnen eindelijk de mysterieuze overgang achter een eeuwenoud chemie-experiment begrijpen. De details van deze transformatie, waarbij het toevoegen van elektronen aan een helderblauwe ammoniakoplossing het verandert in een glanzend, metallisch brons, zijn wetenschappers lang ontgaan..
De nieuwe studie onthult de subtiele details van deze verandering en laat zien dat deze transformatie geleidelijk is in plaats van plotseling. "Wat we met succes hebben gedaan, is dat we vrijwel hebben begrepen hoe deze oplossingen zich gedragen bij een breed scala aan concentraties met behulp van een microjettechniek", zei co-auteur Ryan McMullen, een doctoraalstudent scheikunde aan de University of Southern California. . Deze techniek, waarbij haardunne stromen van de oplossing door een vacuüm worden geschoten, is nog niet eerder op de glanzende vloeistof toegepast..
En de ontdekking zou in de toekomst nieuwe soorten reacties in de organische chemie kunnen openen, vertelde McMullen .
Verwant: 8 chemische elementen waarvan je nog nooit hebt gehoord
Wat is een metaal?
Metalen zijn een diverse groep. Sommige, zoals lithium, zijn licht genoeg om te drijven, terwijl andere, zoals lood of osmium, extreem dicht zijn. Sommige vereisen ongelooflijk hoge temperaturen om te smelten, terwijl andere gemakkelijk smelten (kwik smelt bijvoorbeeld bij min 38,3 graden Celsius of min 37,9 graden Fahrenheit). Wat metalen uiteindelijk gemeen hebben, is hun vermogen om elektriciteit op het absolute nulpunt te geleiden, het punt waarop de moleculaire beweging door warmte in wezen stopt..
Maar hoe transformeren sommige niet-metalen in metalen? In een nieuwe studie beantwoordden onderzoekers die vraag door metalen toe te voegen aan vloeibare ammoniak.
Ten eerste condenseerden de onderzoekers ammoniak, een gas bij kamertemperatuur, in een vloeistof door het af te koelen tot een negatieve 27,4 F (minus 33 C). Vervolgens voegden ze natrium, lithium of kalium toe, allemaal alkalimetalen. (Het is vrij beroemd dat deze metalen explosief reageren wanneer ze in water worden ondergedompeld.) De experimenten werden uitgevoerd in samenwerking met wetenschappers van de Tsjechische Academie van Wetenschappen en het Fritz-Haber Instituut van de Max Planck Society in Berlijn, evenals onderzoekers in Japan en Frankrijk..
Verwant: De top 10 van grootste explosies ooit
Het resultaat was een verwachte reactie: de vloeibare ammoniak trok elektronen uit het metaal. Die elektronen kwamen vervolgens vast te zitten tussen de ammoniakmoleculen, waardoor de zogenaamde gesolvateerde elektronen ontstonden die de onderzoekers hoopten te bestuderen. Bij lage concentraties was het resultaat een blauwe, niet-metallische vloeistof. Terwijl de gesolvateerde of gevangen elektronen zich opstapelden, veranderde de oplossing in glanzend brons.
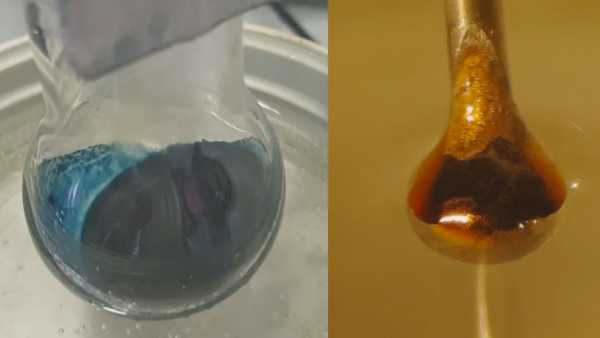
De volgende uitdaging was om te onderzoeken hoe de gesolvateerde elektronen zich bij verschillende concentraties gedroegen. Dit omvatte het fotograferen van een microjet van de oplossing - ongeveer de breedte van een mensenhaar - door een bundel synchrotron-röntgenstralen, die röntgenstralen met hoge energie zijn. De röntgenstralen hebben de gesolvateerde elektronen opgewonden, waardoor ze uit hun vloeibare kooi van ammoniakmoleculen springen. De onderzoekers konden vervolgens meten hoeveel energie het kostte om de gesolvateerde elektronen vrij te maken.
De onderzoekers ontdekten dat hoe groter de concentratie van gesolvateerde elektronen, hoe meer het patroon van energie-afgifte overeenkomt met wat er in een metaal wordt gezien. Dit is wat dat betekent: als je de hoeveelheid energie in kaart brengt die nodig is om elektronen uit hun vloeibare ammoniakkooi te bevrijden, hebben metalen meestal een zogenaamde "Fermi-rand", een zeer abrupte overgang, zei McMullen. Bij lagere concentraties van gesolvateerde elektronen lijkt deze energieafgiftegrafiek meer op een ronde heuvel. Pas bij hogere elektronenconcentraties kwam deze Fermi-rand tevoorschijn. De rand geeft weer hoeveel energie elektronen hebben bij een bepaalde temperatuur, voegde McMullen eraan toe.
"Als je de concentratie verhoogt naar het metaalachtige bereik, dan zie je, komt dit prachtige patroon naar voren dat heel, heel kenmerkend is voor een metaal", zei McMullen.
De resultaten waren interessant omdat ze aantoonden dat de metaalachtige vloeistof die ontstaat door het combineren van alkalimetalen en ammoniak eigenlijk een metaal is op een fundamenteel fysiek niveau, zei hij..
"Het is een echt metaal, het is niet iets dat er maar zo uitziet", zei McMullen.
Solvateerde elektronen met een lagere concentratie worden gebruikt in een soort reactie die een berkenreactie wordt genoemd, die elektronen toevoegt aan moleculaire structuren die aromatische ringen worden genoemd. Dit soort reactie werd gebruikt bij de vervaardiging van de eerste orale anticonceptiepillen in de jaren vijftig, zei McMullen. Door te begrijpen hoe gesolvateerde elektronen bij hoge concentraties werken, kunnen onderzoekers mogelijk nieuwe soorten chemische reacties vinden, zei hij. Ze zouden bijvoorbeeld de gesolvateerde elektronen kunnen exciteren met lichtstralen om ze zich op nieuwe manieren te laten gedragen.
"Als je de elektronen een beetje kietelt zodat ze energetisch meer opgewonden raken, kun je beginnen te kijken naar een aantal gekke reacties die anders nooit zouden gebeuren," zei McMullen..
De onderzoekers rapporteerden hun bevindingen op 5 juni in het tijdschrift Science.
Zie alle reacties (2)














